사용적합성 테스트
사용적합성테스트 수행 시기

- 사용적합성 테스트 수행 시기
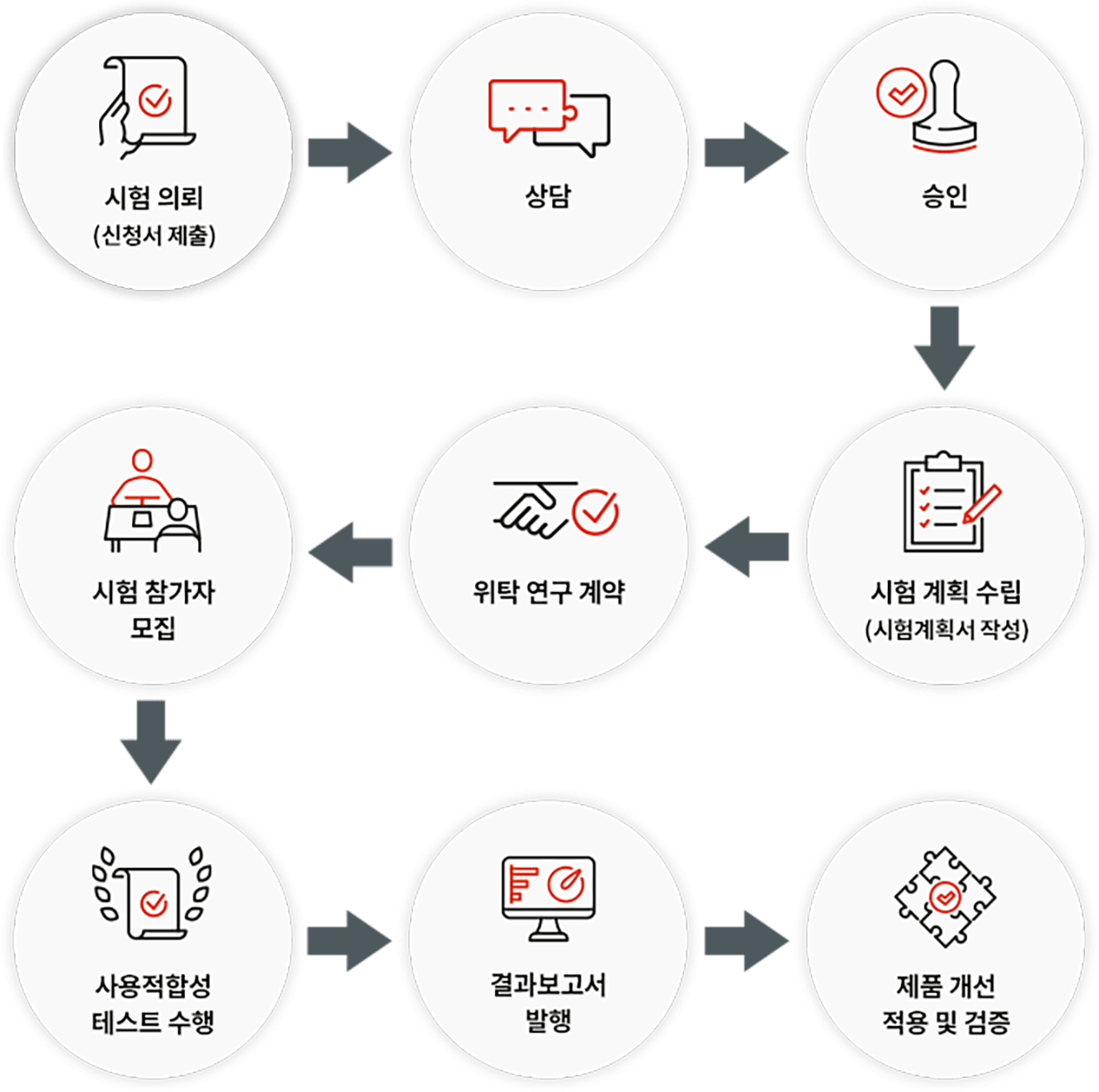
- 사용적합성 테스트는 통상적으로 의료기기의 인허가가 나기 이전에 미리 준비해야 하는 위험관리의 한 영역이며, 이를 통해 기업은 사용적합성 엔지니어링 프로세스 및 파일을 구축해 두어야 합니다. 최근에는 GMP 심사를 대비하기 위해 인허가가 끝난 제품의 경우도 사용적합성 테스트를 진행하는 경우가 있습니다.
- 진행과정
-

사용적합성테스트의 필요성

- 제도적 측면
-
- 의료기기 기업이 GMP(Good Manufacturing Practice, 우수 제조‧품질관리 기준) 인증을 받기 위해서는 모든 등급의 의료기기 대상으로 사용적합성 테스트 활동을 수행해야 합니다.
*ISO 13485:2016 국제규격 기반
- 전기전자 의료기기 관련 기업이 국내외 기관으로부터 품목 인허가를 받기 위해서는 사용적합성 테스트 활동을 수행해야 합니다. 이 때의 사용적합성 테스트는 사용적합성 엔지니어링 프로세스를 이행했는지 여부와 함께 질적인 측면에서도 위험분석, 평가, 위험통제가 적절히 이루어졌는지 인허가적 측면에서 평가가 이루어질 수 있습니다.
*IEC 60601, 62366 국제규격 기반
- 의료기기 기업이 GMP(Good Manufacturing Practice, 우수 제조‧품질관리 기준) 인증을 받기 위해서는 모든 등급의 의료기기 대상으로 사용적합성 테스트 활동을 수행해야 합니다.
- 제품 향상적 측면
- 사용적합성 테스트를 수행하면 의료기기의 설계, 개발, 시제품 제작, 사용자 인터페이스 구축 등의 과정에서 전문적인 의료진의 피드백을 통해 위해요인 및 사용오류 발굴, 평가, 위해요인 통제 등이 가능해져 보다 안전하고, 사용만족도가 높은 제품 개발을 추진할 수 있습니다.
사용적합성테스트의 종류

- 형성평가(Formative Test) :
- 분당서울대학교병원, 성남산업진흥원 수행
- 의료기기의 설계, 제품개발, 시제품제작 초기 등 제품형성 과정에서 진행
- 총괄평가(Summative Test) :
- 분당서울대학교병원 수행
- 의료기기가 안전하게 사용될 수 있다는 객관적 증거를 얻으려는 목적으로 제품 및 사용자 인터페이스 완성단계에서 진행
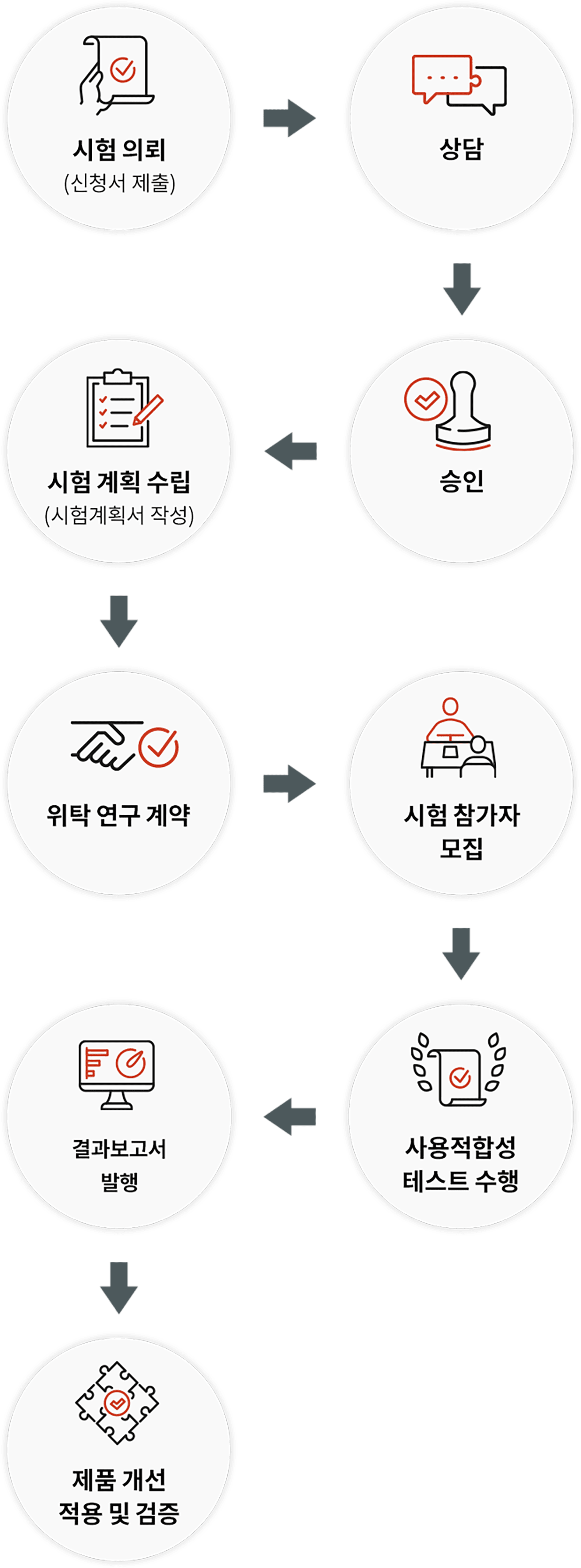
수행 절차

- 수행 절차
-